Si bien los procesos celulares in vivo ocurren en 3D, la microscopía celular (y el cultivo) han sido utilizados principalmente en 2D por las facilidades técnicas que presenta. Sin embargo, la cuantificación 3D es fundamental para entender procesos en áreas como el desarrollo.
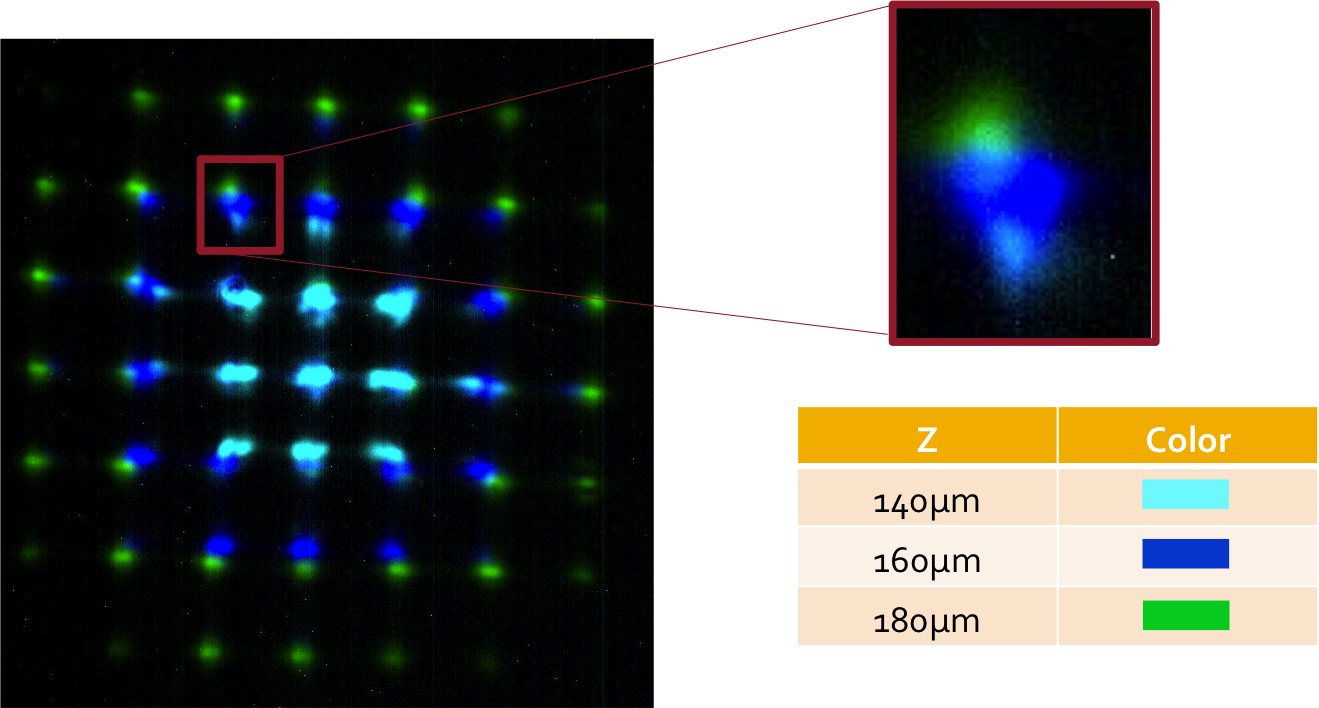
Por este motivo, desarrollamos técnicas de microscopía tridimensional que nos permiten monitorear la dinámica espacial de procesos celulares. Mas aún, buscamos combinar las técnicas de microscopía funcional como FCS, FRET, FLIM con microscopía 3D de forma tal de poder observar procesos moleculares. Para este fin, desarrollamos Light Field Microscopy donde se busca multiplexar la información axial mediante la generación y posterior adquisición de una transformada de Fourier local. También desarrollamos Light Sheet Microscopy para observación de cultivo 3D.
Utilizamos estas técnicas para estudiar la organización tridimensional espacio-temporal de ROS y su relación con la propagación de señales apoptóticas. Dado que ROS puede actuar como inhibidor de sus mecanismos de control y activador de su generación, podría darse una cascada que propague señales rápidas y de largo alcance a pesar de su alta reactividad. Esto podría explicar la respuesta global de los receptores de membrana ante un estimulo local y estimular la respuesta apoptótica para pequeñas dosis locales de ROS. Mediante el desarrollo de nuevos métodos en bioimaging, exploramos estos conceptos observando directamente ROS intracelular y sus efectos luego de una estimulación local.